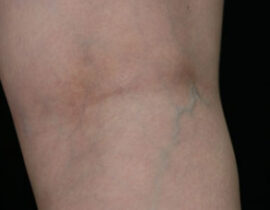
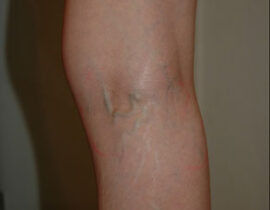
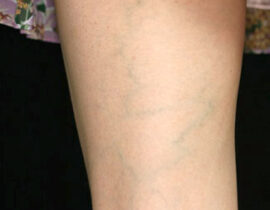
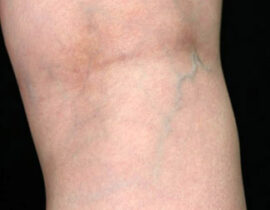
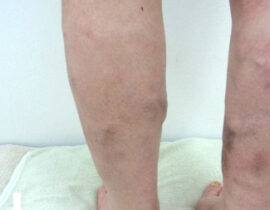
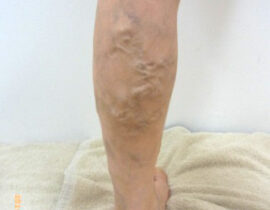
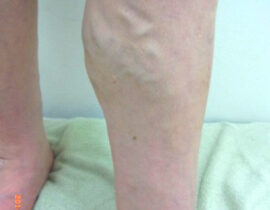
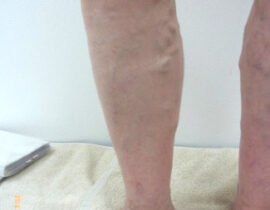
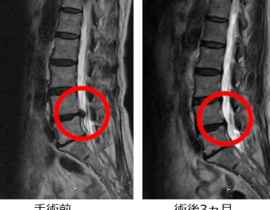
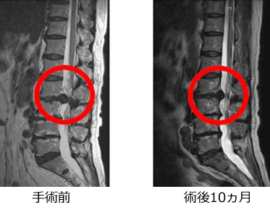
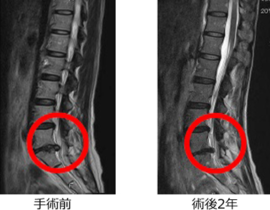
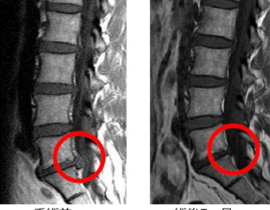
腫瘍崩壊症候群
>>未承認医療(自費診療)に関して「治療空白領域への未承認医療実施に関する倫理・人道的正当性」
遺伝子治療の現況と経緯
2025年9月
当院で提供しておりました遺伝子治療(CDC6shRNA治療)は、厚生労働省及び環境省の措置命令により2025年8月から提供停止を余儀なくされております。本治療を高くご評価され期待をかけてくださる方々、そして予後の改善及び延命目的で本治療の継続が必要な患者さん方に多大なるご迷惑とご不安をおかけしておりますことを深くお詫び申し上げます。
本遺伝子治療は、標準治療で十分な管理ができない進行末期がんの複数の患者さんが延命目的に海外で受けたところ、副作用がなく劇的な効果が得られるので国内で継続して治療を受けたい、と相談に来られたことを契機に治療提供についての検討を始めたものです。当初は科学的な検証が不十分な未承認治療であることから当院での治療実施は難しいとお断りをしました。しかし、その後、「国内の医療機関では見放されているが、この治療を続ければ命を繋ぐことができる、まだ自分は仕事もしており家族も残されている、何とかこの治療の提供をしてもらえないか」等、複数の患者さんの切実な願いに応えられないかと治療提供の可否について検討をしました。新薬の開発に必須の臨床治験が行われていませんでしたが現に何人もの進行末期がんの患者さんが緊急避難的治療として本治療を必要としており、特に大きな副作用の発現もなく、治療内容に科学的合理性はあることから、適応をしっかりと見極めて治療提供をすることは医療倫理に悖らないと判断しました。提供開始にあたっては、厚生労働省の担当者に本治療を合法的に実施するための注意点を確認し、治療においては自由診療で実施すること、海外の製剤は厚生労働省地方支部局である厚生局の許認可の下、医師個人輸入で確保することを指示され、以降、それに従って治療を継続してきたため法令遵守も担保されているとの認識でした。
当初は、口コミで当院を受診し治療を希望する進行末期がんの患者さんに対応していましたが、末期がんで死期が数日後に迫るレベルの患者さんが治療に過度な期待を抱いて飛び込みで受診するようになったことから、治療内容に関して誤解を招かないように情報の開示を徹底するよう留意しました。その後、有効な標準治療が無いと宣告されたステージ4のがん患者さんや、難治がんの一つスキルス胃がんの患者さんの著効例もみられるようになり、さしたる副作用がないことから本治療の提供継続は医療的にも人道的にも意義があると判断いたしました。有効な標準治療の選択肢が尽きた進行がん、再発がんの患者さん方は、複数の未承認治療を並行して受けていることが多く、本遺伝子治療の客観的評価が容易ではありません。しかしながら、標準治療で治療対象外とされた難治がんの患者さん方が、本治療を受けることで症状の改善(疼痛緩和、食欲増進、腫瘍マーカー改善など)を自覚されることがしばしばあり、本治療の継続は妥当であると評価しておりました。客観的な治療効果の評価に関する科学的な手法も並行して模索していました。
そのような中で、2025年の厚生労働省担当下の再生医療等安全性確保法の改正にあたって、その対応を確認するために受講した講習会で、遺伝子治療は、今後、再生医療等安全性確保法の管理下におかれるのみならず、環境省が主担当となるカルタヘナ法(遺伝子組換え生物等の使用等による生物多様性への影響を防止するための法律)の申請許可も必要である旨の説明を受けました。それまで治療に用いる遺伝子製剤はその輸入の際に、毎回、厚生局の許可を取得していたことから合法的な治療提供であると認識しておりましたし、進行再発がんや末期がんの多くの方々が本遺伝子治療により命を繋がれていたため治療の中断をしかねることもあって、治療提供を維持しながら同法の申請許可を得るための手続きを迅速に進められるよう当局に打診を重ねましたが、法令遵守及び治療停止の措置命令を受けるに至りました。
私共は患者さんの視点に立って医療を提供することを常に心がけておりますが、言わずもがな、法令遵守の下での医療提供に注視してきました。それ故、今回の経緯は誠に遺憾であり不本意ではありますが、改めて法令遵守のために細心の注意を払い、本治療の早期再開が必要な患者さん方の期待に応えられるよう速やかに治療の再開を果たすべく再生医療等安全性確保法及びカルタヘナ法の手続きに急ぎ着手しております。同法の申請手続きにおいて、行政府の承認、許可を得るのに相応の時間を要すると聞いておりますが、可及的速やかに治療の再開が果たせるように尽力いたします。
本治療を高く評価され期待をかけてくださる方々、そして何よりも予後の改善及び延命目的で本治療の継続が必要な患者さん方には、このたび遺伝子治療を中断せざるを得なくなりましたこと、改めて心よりお詫び申し上げます。皆様には多大なるご心配とご迷惑をおかけいたしますが、引き続きご支援ご鞭撻を賜りますよう、何卒お願い申し上げます。
北青山D.CLINIC 院長 阿保義久
遺伝子治療提供開始から一時停止に至った事情
↓
・治療内容、治療の科学的背景等を確認。治療選択肢がない進行末期癌の患者の治療要請に応じるのは医療倫理的に妥当、かつ治療設計やその効果に科学的合理性があると判断。
↓
・厚生労働省担当窓口に相談
① 本治療を国内で提供できるか
② 提供できる場合はどのようにすべきか➡自由診療、医師個人輸入で対応可との回答。
↓
・患者さんの口コミ、紹介で治療希望者の受診増。治療適応外の末期癌の患者さんの飛び込み受診増加。➡過度の期待・誤解の回避目的に治療内容の詳細を公開(サイト等)。
↓
・進行末期癌の患者さんへの治療継続。スキルス胃癌やステージ4の進行末期癌で症状が改善安定する症例が増加。治療の継続を必要とする患者さんが急増。
↓
・2024年 再生医療等安全性確保法が2025年5月31日に改正され遺伝子治療が同法整備下に入るとの予告あり。➡法律改正への対応準備開始。
↓
・2009年当初から、試薬の入手は厚生労働省内の地方厚生局の許可を取得して医師個人輸入していたため、最初から継続して合法的な治療を提供してきたとの認識。
↓
・2025年1月 再生医療等安全性確保法改正にあたっての講習会受講。遺伝子治療の実施には再生医療等安全性確保法に加えてカルタヘナ法への申請許可が必要と説明される。
↓
・2025年2月 厚生労働省担当窓口に、法抵触への疑念と治療継続のための手続きについて打診、相談。
↓
・2025年6月 再生医療等安全性確保法改正直後、カルタヘナ法抵触を理由に報告書の提示を求める通知あり。➡経緯、核酸化合物情報、生物多様性評価等報告。
↓
・2025年7月 措置命令の予告および弁明機会付与の通知あり。
↓
・2025年8月22日 カルタヘナ法下の措置命令発出。 ➡早期治療再開のため措置受諾。
遺伝子治療再開に向けてのロードマップ 厚生労働省担当窓口に文書確認済
↓
・製造所認定取得。
↓
・特定認定再生医療等委員会新設作業。 ※
↓
・特定認定再生医療等委員会審議、承認
↓
・厚生労働省内の厚生科学審議会で審議
↓
・厚生労働科学審議会で承認
↓
・カルタヘナ法許可申請
↓
・カルタヘナ法承認
↓
・遺伝子治療再開
※既に設立されている北青山Dクリニック特定認定再生医療等委員会に加えて
遺伝子治療の審議専用に新たな委員会を設置するよう厚生労働省より指示あり。
<今回の委員会設立に必要な構成委員>
・分子生物学、細胞生物学、遺伝学、臨床 薬理学又は病理学の専門家
・再生医療等について十分な科学的知見 及び医療上の識見を有する者
・臨床医(現に診療に従事している医師 又は歯科医師をいう。)
・特定核酸等 の製造に 関する識見を有する者
・医学又は医療分野における人権の尊重 に関して理解のある法律に関する専門家
・生命倫理に関する識見を有する者
・生物統計その他の臨床研究に関する識 見を有する者
・一般の立場の者
・遺伝子治療が人に与える影響について 十分な科学的知見及び識見を有する者
・核酸等に係る遺伝子組換え生物の取扱いについて科学的知見及び識見を有する者 ➡カルタヘナ法に関する専門的知識を有し、厚生労働大臣及び環境大臣が生物多様性影響に関し意見を聴く学識経験者