1.大腸がんとは
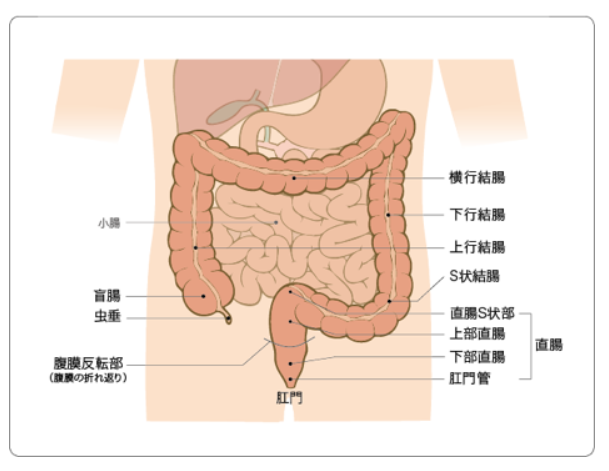
大腸とは
大腸は小腸につながる消化管の最終部分です。私たちが摂取した食事が、消化、吸収、排泄(はいせつ)される過程で通過する消化管が順に、口→食道→胃→十二指腸→小腸→大腸 となります。これらの中で、消化に関わるのが主として胃・小腸、消化された栄養物の吸収は小腸が担っています。大腸は、水分の吸収と、最終的に形成された便を一定期間貯留しその排泄をするのが主たる役割です。
大腸は、小腸とつながる右下腹部の盲腸から始まり、上行結腸、横行結腸、下行結腸、S状結腸と小腸を取り囲むように腹部全体を走行して、下腹部の部分で直腸、肛門と続きます。これらすべてを一括して大腸と呼びます。
がんセンター「がん情報サービス」より
また、大腸は脳神経の次に神経細胞数が多いことがわかっています。心理的なストレスの影響を受けて大腸の機能が変化しやすいのはそのためとも言われています。そして、大腸には大腸菌、乳酸菌、ビィフィズス菌など100種類以上の腸内細菌が生息しており、これらの菌は食物繊維の分解や感染症予防など様々なはたらきをすることがわかっています。腸内細菌は免疫機能との関わりが深いことが以前から指摘されていましたが、腸内細菌のコンディションが動脈硬化、肥満、認知症、がんなど様々な疾患に関与し得ることも最近注目されています。
大腸がんとは
大腸がんは、盲腸・上行結腸・横行結腸・下行結腸・直腸・肛門いずれかの粘膜から発生するがんです。発生部位を見ると、直腸がんとS状結腸がんが多く、それぞれ全体の約35%を占めます。次いで、上行結腸がん、横行結腸がんがそれぞれ約10%、盲腸がん、下行結腸がんが約5%と続きます。直腸がんとS状結腸がんを合わせると70%になるわけですから、大腸がんは肛門に近い部分に発生しやすいと言えます。
日本人のがんによる死亡率は年々増えていることが報告されていますが、中でも特に増えているのが大腸がんです。この20年で4倍に増えており、年間10万人もの人が大腸がんを発症しています。
2.大腸がんの特徴
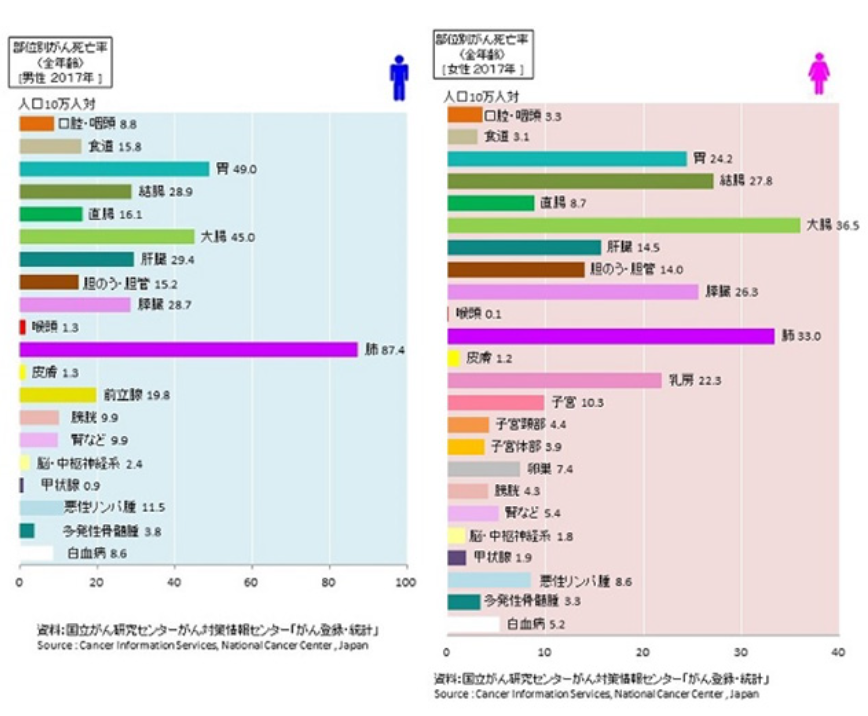
大腸がんの罹患率、死亡率
日本では食生活の欧米化に伴い1990年代半ばまで、男女を問わず大腸がんの罹患率(1年間に大腸がんと診断された人の人口10万人当たりの割合)は毎年増えていました。以降、高齢化の影響を排除した年齢調整罹患率では増加傾向はやや緩徐になりましたが、依然として大腸がんの罹患率は増加傾向の一途です。年齢別では、40歳以降から罹患率が増加しだし50歳以降になると増加率がさらに大きくなります。がんの発生部位別の罹患率では、大腸がんは、男性では胃がん、肺がんに次いで第3位、女性では乳がんに次いで第2位です。さらに死亡率を見ると、男性では罹患率と同様に3位ですが、女性では2003年以後は第1位となっています。罹患率、死亡率とも男性は女性よりもやや高めです。大腸がんは罹患率、死亡率ともに上位の主要ながんといえます。
日米の違い
2017年の日本の大腸がんの罹患数は15万人程度、死亡者数は5万人程度です。一方、米国ではそれぞれ約13万5千人、5万人です。日本の人口約1億2千500万人に対して米国は3億2千万人で日本の約2.5倍です。それにもかかわらず、大腸がんの罹患数は日本の方がやや多く、死亡数は両国でほぼ同数です。人口比から考えると日本は大腸がんの罹患数・死亡数ともいかに多いかがわかります。
米国の大腸がん減少の要因
1970年代から米国では「がん撲滅」をそのスローガンに掲げて国を挙げてがん対策に励んできました。その効果はすぐには表れませんでしたが、1990年代から、大腸がんを始めとしたがんの罹患数・死亡数とも減少し続けています。特に、50~75歳の人が無料で大腸がん検診を受けられるようにしたこと、70%近くの人が何らかの大腸がん検診を受けていること、そして50~75歳の過半数が過去10年以内に大腸内視鏡検査を最低1回は受けていることなどが、大腸がんの減少に影響したと考えられています。
がんの罹患数や死亡数を減少させる要因として、予防(食事・運動などの生活習慣の管理)、検診(スクリーニング)の励行、治療の進歩の3つの観点で検討した場合に、もっとも貢献度が大きいのは検診であることが研究調査によって明らかになっています。
日本の大腸がん検診受診率は米国に比べるとまだまだ低いことが指摘されます(男性44.5%、女性38.5%)。大腸内視鏡検査の技術は、日本は国際的にトップクラスです。日本にいながらその技術の恩恵を受けない理由はないでしょう。
大腸がんは治癒可能ながん
今やがん全体の治癒率は60%を超えています。早期に発見すればするほど、がんの治癒率が大きくなることも分かっています。大腸がんはその中でも、より治りやすいがん、根治を期待できるがんと言えます。大腸内視鏡検査で早期発見ができれば、内視鏡検査時に完全に切除(根治治療)することも可能で、内視鏡で切除できなくとも比較的早期であれば、手術(外科治療、最近は腹腔鏡下治療が主流)で、ほとんどが治癒可能です。進行した大腸がんであっても、進行の程度が軽い場合や、肺や肝臓などへ転移した場合(ステージ4)であっても手術で完全切除が可能であれば治せることが少なくありません。
このように大腸がんが治りやすい、根治を期待できるがんである理由は、その組織型が高分化型の腺がんという、正常組織と区別がつきやすく悪性度が低い比較的おとなしいタイプであるため、と考えられています。また、大腸自体が切除しやすい臓器であることもその理由の一つです。大腸は酸素や栄養を供給する支配動脈が限られており、転移の可能性が大きい周囲のリンパ節の解剖的位置関係が比較的明瞭です。そのため、がんの発生部位や大きさ、進行度に応じて、切除範囲が明確で治療法が標準化しやすいという特徴があります。さらに、転移する場所も比較的限られており、肝臓や肺がほとんどです。それらの臓器に転移した場合でもがんの部分を完全に切除することができれば根治できる可能性があります。
ただし、大腸がんは自覚症状が現れないことが多く、検診を怠ったために発見が遅れると、病巣が広がってがんが大腸の壁深くに入り込み、リンパ節や他臓器など広範囲にがんが転移すると、手術で完全に除去することが困難になります。その場合は抗がん剤治療や放射線治療が実施されることになりますが、そうなってくると根治が非常に難しくなります。
3.大腸がんの原因
大腸がんの発生の背景には生活習慣が大きくかかわっていると考えられています。遺伝的に大腸がんを発症する家族性ポリポーシスなども存在しますがほとんどの大腸がんは後天的に要因で発症します。日本で大腸がんが昨今増えている理由は生活習慣の欧米化と運動不足と言われています。
一般的に大腸がん発症リスクとして挙げられるのは以下になります。
- 肥満
- 喫煙
- 大量飲酒
- 赤身肉、加工肉摂取過多
- 食物繊維(穀類、豆類、野菜)の摂取不足
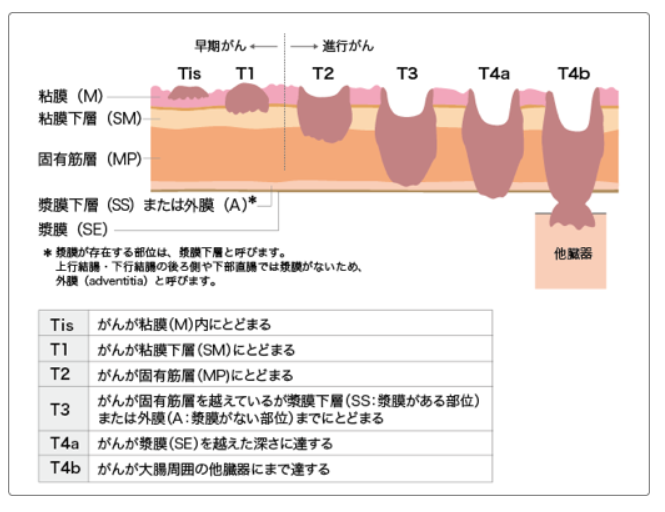
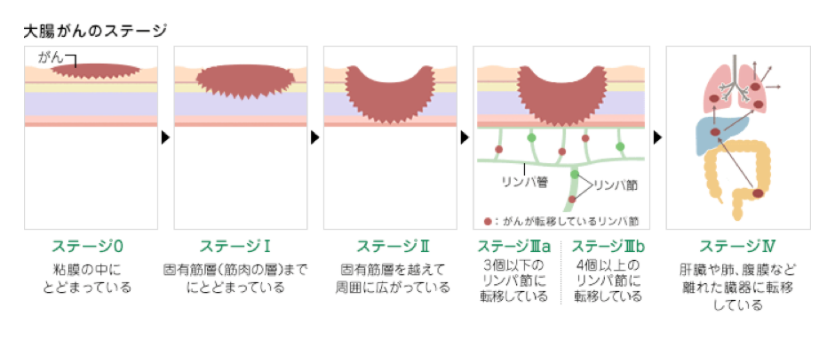
4.大腸がんの進行度
大腸がんの進行度の判定は、画像検査や病理検査で得られた情報から、
①大腸壁への深達度(T)
②リンパ節転移の程度(N)
③遠隔転移の有無(M)
の3つのポイントに基づき評価され、最も早期のがんがステージ0、以降進行するにつれて、ステージⅠ、Ⅱ(a、b、c)、Ⅲ(a、b、c)、Ⅳ(a、b、c)と分類されます。
大腸がんの進行度によって治療法が異なり、ステージが早ければ、低侵襲で根治的な治療が可能になります。例えばステージ0では内視鏡による低侵襲の切除が可能ですが、ステージⅣになると手術による治療が不能のために、化学療法を選択することになる場合が多くなります。
①大腸壁への深達度
国立がんセンターホームページより
②リンパ節転移
リンパ節転移は、以下のように表されます。
N0: 領域リンパ節転移を認めない
N1: 腸管傍リンパ節と中間リンパ節の転移が1〜3個
N1a: 腸管傍リンパ節と中間リンパ節の転移が1個
N1b: 腸管傍リンパ節と中間リンパ節の転移が2〜3個
N2: 腸管傍リンパ節と中間リンパ節の転移が4個以上
N2a:腸管傍リンパ節と中間リンパ節の転移が4〜6個
N2b:腸管傍リンパ節と中間リンパ節の転移が7個以上
N3: 主リンパ節に転移を認める。
下部直腸癌では、主リンパ筋あるいは側方リンパ節に転移を認める
③遠隔転移
遠隔転移は、以下のように表されます。
M0:遠隔転移を認めない
M1: 遠隔転移を認める
M1a : 1臓器に遠隔転移を認める
M1b : 2臓器以上
M1c: 腹膜転移を認める
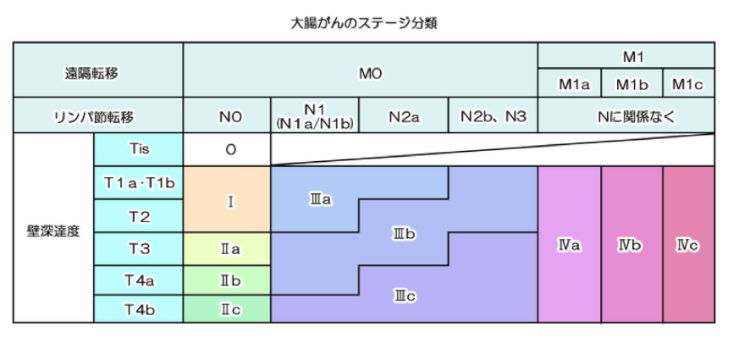
以上①~③を踏まえて大腸がんのステージ分類は以下の表のようになります。
大腸癌取扱い規約 第9版.大腸癌研究会 編.金原出版.2018.より引用
5.大腸がんの予後
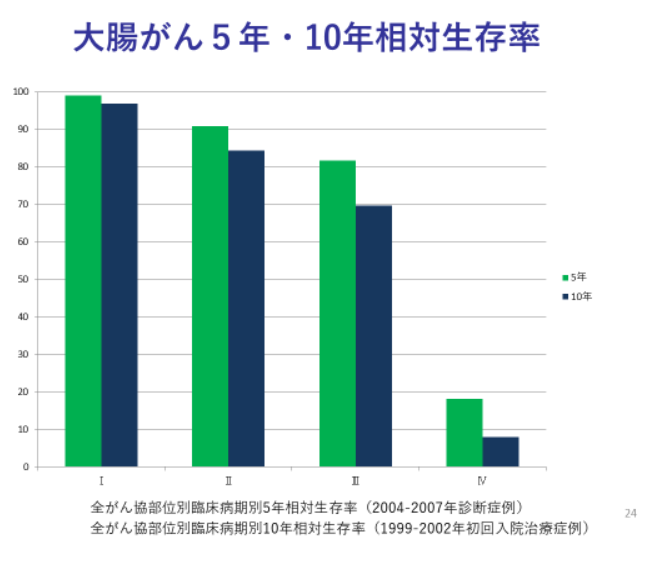
がんと診断され治療を受けてから5年経過した後に生存している人の割合を5年生存率といいます。大腸がんを含めた多くのがんの再発は治療後5年以内に起こることがほとんどなので、5年間生存することが完治の目安になります。最近は10年生存率も集計されるようになり、治療後5年以上経過してから再発する例もゼロではないことが示されましたが、がんに対する治療成績を評価する上では現在においても5年生存率が一般的に用いられます。早期に治療を受けた場合ほど、5年生存率と10年生存率の乖離は小さくなります。
国立がん研究センターが分析した大腸がんのステージ別5年生存率をみると、 以下のように、ステージⅠ、Ⅱでは90%を超え、ステージⅢでも80%以上となっておりますが、ステージⅣになると20%程度と大きく低下していることがわかります。早期で発見できれば大腸がんは根治率の高いがんと言えますが、発見が遅れて遠隔転移を来してしまうと急激に予後は悪化してしまうのです。
6.大腸がんの検査と診断
早期発見の重要性
日本消化器がん検診学会の「全国集計調査」(2013年度)によると、大腸がん検診で発見されたがんのうち、48%は内視鏡治療で済んでいると報告されています。大腸がん は早期で発見されれば、このように内視鏡による切除のみで根治的治療となることが少なくありません。定期的な検診を受けることで早期発見が可能となり、治療が必要になっても、体への負担はもちろん時間や費用の負担も最小限になるといったメリットがあります。大腸がん早期発見のために必要な代表的な検査として「便潜血検査」と「大腸内視鏡検査」が挙げられます。
便潜血検査
日本の自治体で集団検診として行われているのは便潜血検査です。大腸がんが発生した部位を便が通過する際に、がん表面の組織に便が擦れて出血が生じます。そして微細な血液が便中に混じます。便潜血検査は便中に潜む肉眼では見えないこの微量な血液の有無を調べる検査です。
具体的な方法としては、採便棒で便の表面をこすり所定の容器に入れて提出するだけです。簡単で安価、副作用や事故もない安全な検査方法です。また、便潜血検査は、がん検診としての有効性に関するしっかりとした根拠があります。すなわち、大腸がんによる死亡率を60~80%低下させ進行がんを約50%減らすことができるとされています。
一方、デメリットとしては、実際にがんが存在しているのに見逃されてしまう偽陰性の結果となりがんの発見が遅れてしまうことがあることや、逆にがんがないのに生理的な出血を検出して偽陽性となり精神的な不安や追加の内視鏡検査負担を強いられてしまうことなどが挙げられます。しかし、これらのデメリットを考慮しても便潜血検査はそのメリットが非常に大きいので、大腸がん早期発見のためには欠かせない検査として40歳以降の方は毎年受けることをお勧めします。偽陰性や偽陽性の発生をできるだけ低くするためには日を分けて2回採取する方法が大切と言われています。
大腸内視鏡検査
便潜血検査で陽性反応が出た場合は、精密検査として大腸内視鏡検査を受けることが推奨されます。大腸内視鏡は、先端にライトと小型レンズが付いた細長い管状の内視鏡で、胃内視鏡(胃カメラ)と構造は基本同一ですが、肛門、直腸、S状結腸、下行結腸、横行結腸、上行結腸、盲腸、回腸末端部と観察範囲が広いので胃内視鏡よりもやや大型です。大腸内視鏡検査では、内視鏡が肛門から大腸内に挿入され、モニター画面に映し出された大腸粘膜の状態が詳細に観察されます。がんがなくても、ポリープなど前がん病変が疑われた際には、形状をしっかりと観察して必要に応じて組織を採取し病理検査に進みます。放置すると将来がん化の可能性が否定できない病変は、よほど大きくなければ内視鏡検査の際に内視鏡による切除手術がしばしば行われます。これにより、病気の早期発見だけでなく同時に早期治療も可能なことが大腸内視鏡検査の大きなメリットの一つです。
<大腸内視鏡検査システム>
https://naishikyou.jp/colonoscope/why.html
近年、大腸内視鏡機器の開発が進み、操作性や解像度の向上だけでなく、患者さんの苦痛を最小限にするための様々な工夫がなされています。医療機関によっては検査時の苦痛をなくすために静脈麻酔を用いて眠った状態で検査を受けられるようにしたり、大腸内の良好な観察を行うために実施する腸管内への送気を吸収が早い二酸化炭素を用いて検査後の腹部の張りを抑えるなど、さまざまな工夫が施されています。
ただし、腸内に便が残っていると内視鏡の挿入や観察ができないので、検査前に大腸内をきれいに洗浄する必要があります。一般的には検査当日に腸管洗浄液を1-2リットル飲んで大腸の中の便をきれいに洗い流します。胃内視鏡検査時に洗腸液を流し込むことで液を飲み込む負担を軽減する方法を実施する医療機関があるようですが、それは消化管に過度の負担がかかる場合がありお勧めしません。
https://naishikyou.jp/practice/column_06.html
大腸内視鏡検査はポリープの切除などがなければ一般的に15~20分程度で終わりますが、開腹手術の既往があり腸管の癒着がある方、そもそも腸管が極端に長い方などは挿入操作が難しく、検査時間が長くなって苦痛を伴うことがあります。そのような場合はなおさら沈痛・鎮静薬が必要になります。
大腸内視鏡検査において、病変が見つかり早期がんで粘膜内にとどまっているレベルであると判断された場合は内視鏡的に摘除します。摘除した病変は病理検査に送られ組織型、悪性度などが調べられます。
がんの位置、深達度や広がり、転移の有無を調べる検査
大腸内視鏡検査で病変ががんと確定され、内視鏡的に完全切除ができない場合に、病気の進行度(ステージ=病期)を正確に判定して治療方針を決定する必要があります。
がんの進行度を決めるために必要な情報は、「4.大腸がんの進行度」の箇所で既に触れていますが、①がんがどの程度大腸の壁に入り込んでいるか(深達度) ②リンパ節に転移があるか ③大腸以外の別の臓器に転移があるか(遠隔転移)、の3つです。
それらの情報を得るために必要な検査は以下になります。
- X線検査
特に胸部X線検査は肺転移がないかどうか心臓や大血管を含めて基礎疾患がないかどうかを評価するために実施されます。 - b>エコー(超音波)検査
がんの広がりや、肝臓およびリンパ節などへの転移がない替え押下を確認するために実施されます。 - CT検査
胸部から腹部骨盤までを水平ないしは鉛直方向の断面像で評価します。がんの位置、形、大きさ、リンパ節や肝臓を含めた多臓器への転移などを確認するために実施されます。 - MRI検査
磁気を用いて画像を作成するため検査の際に放射線被曝を受けずに済みます。がんの位置、広がり、周辺臓器・リンパ節・他臓器への転移の有無を確認するために実施されます。 - PET-CT検査
がん細胞が正常細胞よりも多くのブドウ糖を取り込む性質を利用して、ブドウ糖類似の物質を静脈内に注射しその取り込み具合を画像化することでがん細胞の全身にわたっての遠隔転移の状況を確認できます。この検査が登場した頃は早期がんの発見目的でも実施されましたが、その点では万能ではありません。基本的には転移、再発の評価目的に実施されます。
7.大腸がんの治療法
大腸がんに限らず、がんの根治的治療の基本は外科的切除です。がん細胞は正常細胞が突然変異して発生しますが、発生当初は1個の細胞です。それが、2個、4個、 8個と分裂して増大し、相応の大きさになると転移する力を得て、飛び火(転移)します。転移せずにまだ発生部位にとどまっている間に、完全に手術で取り除くことが できれば根治治療になります。がん病巣を瞬時に取り除く、という点では外科的切除に勝る治療法はありません。放射線治療が外科切除と同等の効果を得る場合もあり、将来は薬剤によりがんの根治治療が可能となる可能性がありますが、現時点での標準治療においては外科的切除により体内から完全にがんを取り除くことが、がん根治的治療においては必要不可欠と言えます。
しかし、外科的切除が可能で、かつ根治的治療として意味をもつためには、手術によりがんが肉眼的にも分子生物学的にも完全に取り除かれることが前提となります。仮に手術で完全にがんが除去できず、体のどこかに一部でも遺残した場合には、一般的に残ったがんが激しく暴れて再発病変として広範囲に進展し悲劇的な結末に至ることがしばしばです。そうならないようにするために、早期発見、早期手術が根治のためには必須となります。
ただ、他のがんに比べて大腸がんは、早期発見が比較的可能で、進行が緩慢であることが多いために、根治的手術においてもより低侵襲な治療を選択することができ、仮に多臓器(肝臓や肺)に転移していても根治的切除が可能となる場合があります。そのため、治療を開始する時点でのステージによって、必要な治療選択肢、治療法は様々です。
大腸癌研究会編「大腸癌治療ガイドライン 2016年版」(金原出版)より
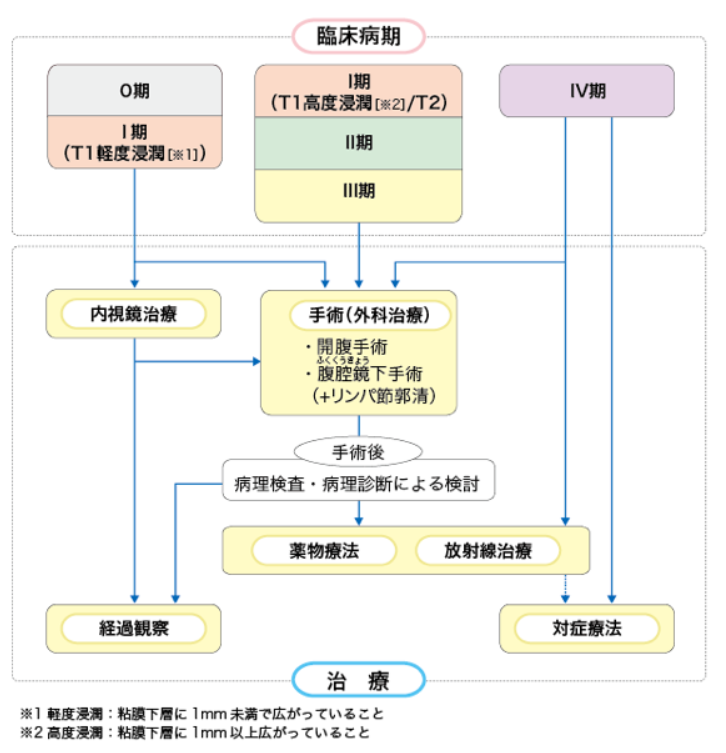
大腸がんの各ステージに応じて標準治療は異なります。各ステージ毎の一般的な治療法は以下の通りです。
①ステージ0
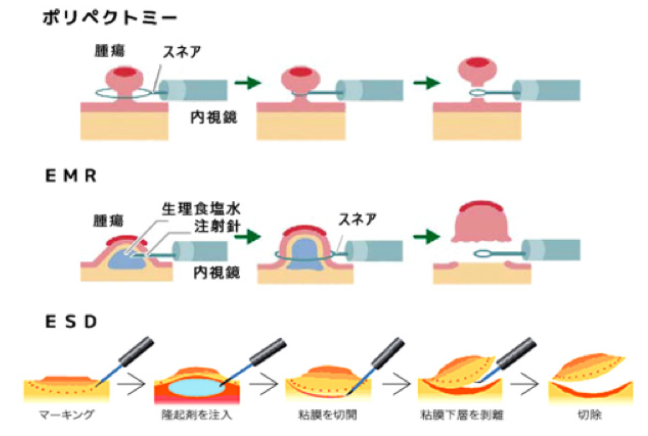
がんが粘膜内に存在して内視鏡的に完全に取り切れる大きさの場合は内視鏡的切除が施行されます。内視鏡による治療法は、病変の大きさや広がり具合によって異なり、ポリペクトミー・内視鏡的粘膜切除(EMR)・内視鏡的粘膜下層剥離術(ESD)の選択肢があります。
ステージ0であってもがんの大きさによっては外科的手術が最初から選択されることがあります。また、内視鏡で切除した病変の病理検査結果によって、追加切除が必要と判断された場合(病巣の深達度が想定よりも大きかった場合)には外科的切除が追加されることがあります。
②ステージⅠ
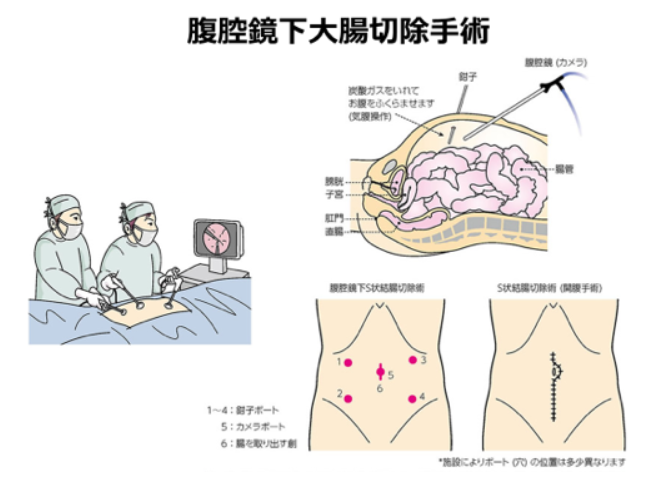
がんが粘膜下層まで達しておりステージ0を超えていても深達度が比較的浅い場合にはステージ1であっても内視鏡的切除が可能です。がんが粘膜下層の深部よりも深いところまで達している場合には外科的切除が選択されます。その場合、がんの存在部位に応じて腸管の切除範囲と転移の可能性がある周辺のリンパ節を同時に切除します。
外科的手術の方法は開腹手術と腹腔鏡下手術があります。がんの存在部位や、患者さんの状態などによってどちらの方法を選択するか決められますが、最近ではより低侵襲の腹腔鏡下手術が選択されるケースが増えています。
③ステージⅡ、Ⅲ
ステージⅠと同様に、がんの広がり具合に応じて適切な範囲の腸管と転移の可能性があるリンパ節(所属リンパ節)を切除します。病理検査で、がんが周囲のリンパ管や静脈に広がっていたり、リンパ節に転移を認めた場合は、術後の補助療法として化学療法や放射線療法を追加することがあります。
④ステージⅣ
多くのがんは遠隔転移のあるステージⅣの場合には手術による切除治療の選択肢はなく、化学療法による延命治療に限られます。しかし、大腸がんは、肝臓や肺に転移していても、肉眼的に完全に切除できる可能性があれば積極的に手術によりがんを取り除くことによって、根治を望める可能性があり、これが大腸がんの大きな特徴です。
ただし、転移の部位や病巣の広がりによっては、外科的切除により病巣の除去が不可能な場合もあり、その場合は化学療法や放射線治療が実施されます。切除手術を伴わないこれら補助治療のみが実施される場合は治療のゴールは根治ではなく延命になります。
8.大腸がんの次世代治療
大腸がんの次世代の治療法、治療薬としては以下が注目されます。
①ロボット支援下手術
ダビンチ・サージカルシステム(通称:ダビンチ)を用いて従来は実施が困難だった直腸がんに対する精密な治療が可能となりました。3Dのフルハイビジョン画像を利用した拡大カメラ(腹腔鏡)による低侵襲手術です。
②新しい分子標的治療薬(BRAF阻害薬、抗HER2治療薬、マルチキナーゼ阻害薬)
がん細胞の増殖に関わるBRAFの阻害薬、がん細胞の膜に存在するヒト上皮成長因子受容体(HER2)をターゲットとした抗HER2治療薬、腫瘍血管新生に関わるVEGFRや腫瘍増殖に関わるBRAFなどの複数のタンパクを制御するマルチキナーゼ阻害薬などがん細胞に特異的な分子を標的にした大きな治療効果が期待されるものですが粘膜障害や手足の痛みなどの副作用が課題です。
③免疫チェックポイント阻害薬
がん細胞を攻撃する免疫細胞(T細胞)に対してその攻撃を抑制するシグナルをがん細胞は出していることがわかっています。そのシグナルを解除するのが免疫チェックポイント阻害薬です。京大の本庶先生がこの治療技術でノーベル賞を受賞したことが良く知られています。万能ではありませんがさまざまながんの治療への応用が期待されます。
④ネオアンチゲン療法
ネオアンチゲン(neoantigen)とは、がん細胞独自の遺伝子変異に伴って新たに生まれた変異抗原のことで、新生抗原、新規抗原、腫瘍特異的変異抗原などとも呼ばれます。ネオアンチゲンは正常な細胞には発現しておらず、がん細胞だけにみられるためそれを標的とした免疫治療は治療ポテンシャルの極めて大きな画期的な治療として世界中で研究が進められています。
⑤CDC6 RNAi 療法
がん細胞の分裂を促すライセンシングファクターであるCDC6タンパクをRNA干渉という先端技術(2006年のノーベル賞受賞技術)を用いて除去する治療です。がん細胞の分裂を止めて自殺に導く画期的な治療特性を持っています。化学療法に比べて副作用が圧倒的に少ない(ほとんど副作用がない)ことも革新的と言えます。
特にロボット支援下手術や分子標的治療薬は既に臨床現場で応用されています。