薬剤発案者へのQ&A
現在、2025年5月31日付けの法改正に伴って遺伝子治療の情報を一時的に非公開としております。
準備が整い次第、がん遺伝子治療に関するページおよび、
公式YouTubeチャンネルに掲載している関連動画公開を再開する予定です。
皆さまにはご不便をおかけしますが、何卒ご理解賜りますようお願い申し上げます。
現在、2025年5月31日付けの法改正に伴って遺伝子治療の情報を一時的に非公開としております。
準備が整い次第、がん遺伝子治療に関するページおよび、
公式YouTubeチャンネルに掲載している関連動画公開を再開する予定です。
皆さまにはご不便をおかけしますが、何卒ご理解賜りますようお願い申し上げます。

再生医療
腹部から脂肪を採取し、細胞培養加工室 CPCで増殖培養し、間葉系幹細胞を投与(左膝関節内への注射及び...

再生医療
① 2019/5/30 ADMSC(自己脂肪由来間葉系幹細胞 adipose-derived me...

再生医療
① 2019/12/6 ADMSC(自己脂肪由来間葉系幹細胞 adipose-derived mes...

再生医療
2019/4/18 脂肪組織採取/血清用採血
再生医療の意思を確認し、同日、脂肪採取および...
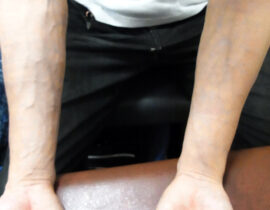
ハンドベイン
両前腕の静脈内に、波長2000nmレーザーファイバーを、20G針を介して挿入、血管内を照射(照射時間...
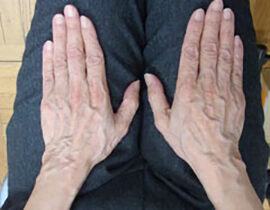
ハンドベイン
両手甲、両前腕の静脈内に、波長2000nmレーザーファイバーを、20G針を介して挿入、血管内を照射(...
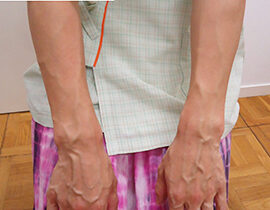
ハンドベイン
両手甲の静脈内に、波長2000nmレーザーファイバーを、20G針を介して挿入、血管内を照射(照射時間...
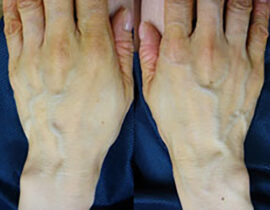
ハンドベイン
両手甲、両前腕の静脈内に、波長2000nmレーザーファイバーを、20G針を介して挿入、血管内を照射(...
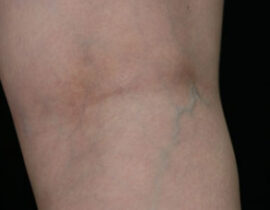
レッグベイン下肢静脈瘤
機種 マイドン 照射回数 1回(G-YAGレーザー使用) 治療内容及び流れについては下記ページ...
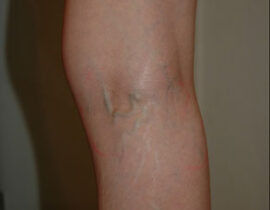
レッグベイン下肢静脈瘤
機種 マイドン(G-YAGレーザー使用) 治療内容及び流れについては下記ページをご確認ください...
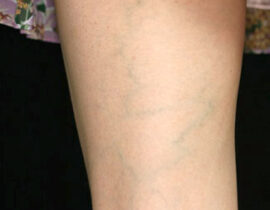
レッグベイン下肢静脈瘤
機種 G-YAG 照射回数 4回 治療内容及び流れについては下記ページをご確認ください。 ・...
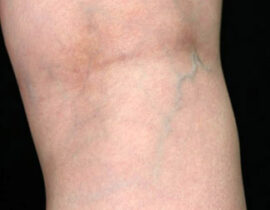
レッグベイン下肢静脈瘤
機種 G-YAG 照射回数 3回 治療内容及び流れについては下記ページをご確認ください。 ・...
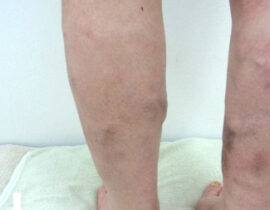
下肢静脈瘤
血管内レーザー治療(2000nmレーザー)を行いました。 治療内容及び流れについては下記ページ...
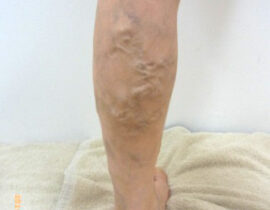
下肢静脈瘤
血管内レーザー治療(2000nmレーザー)を行いました。 治療内容及び流れについては下記ページ...
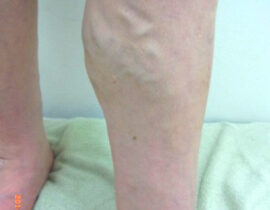
下肢静脈瘤
血管内レーザー治療(2000nmレーザー)を行いました。 治療内容及び流れについては下記ページ...
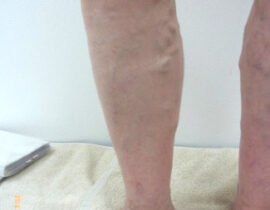
下肢静脈瘤
両下肢の静脈瘤に対してレーザー治療を実施し順調に経過しています。 術後10か月目の時点で残存血管に...

再生医療
腹部から脂肪を採取し、細胞培養加工室 CPCで増殖培養し、間葉系幹細胞を投与(左膝関節内への注射及び...

再生医療
① 2019/5/30 ADMSC(自己脂肪由来間葉系幹細胞 adipose-derived me...

再生医療
① 2019/12/6 ADMSC(自己脂肪由来間葉系幹細胞 adipose-derived mes...

再生医療
2019/4/18 脂肪組織採取/血清用採血
再生医療の意思を確認し、同日、脂肪採取および...
※お電話が繋がりにくい場合がございます。
折り返し電話をご希望の方は「ご相談・お問合せ」よりメールにて承ります。
| 診療時間 | 月 | 火 | 水 | 木 | 金 | 土 | 日 | 祝 |
|---|---|---|---|---|---|---|---|---|
| 9:30-18:00 | ● | ● | ● | ● | ● | ● | - | - |
休診:日曜日・祝日
当院では幅広く、様々な検査に対応しています。
医学的アプローチによる美容治療のご提案がございます。
しこりや違和感があるといった方は、早期受診をおすすめします。
がんは早期発見が極めて重要です。
当院では幅広い疾病に対して日帰り手術を可能にしています。