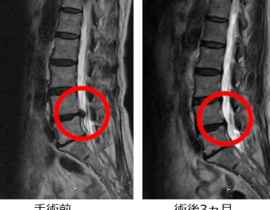
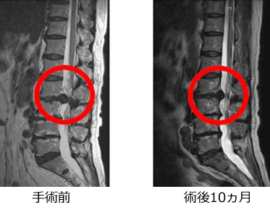
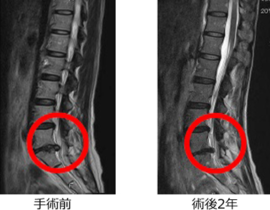
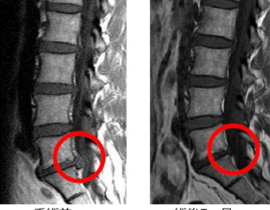
また、学問的背景があっても保険承認がすぐ得られるわけではありません。しかし、新しい治療を開拓していく上では、学問的・科学的に妥当な背景が言うまでもなく求められます。当院で提供しているCDC6をターゲットとした治療が、癌治療として成立する根拠を今回のブログでは記載したいと思います。
ただし、専門性の高い内容になっていますのでご了承いただければ幸いです。
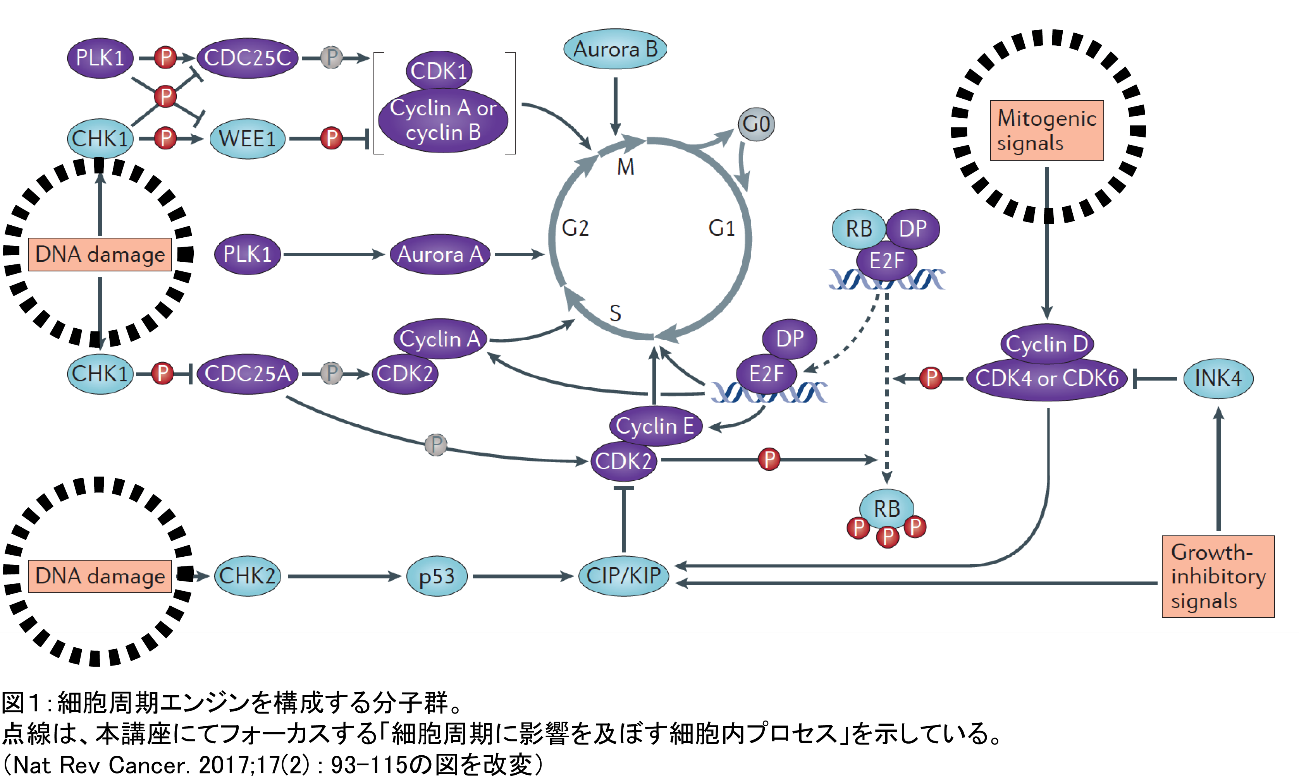
癌は、ゲノムに損傷を受けた異常細胞の無秩序な増殖によって特徴づけられる病態です。癌細胞の無秩序な増殖は細胞周期が正常に制御されなくなるために生じ、その主たる原因として、①細胞周期エンジンを構成する分子群(及びその遺伝子座)の変異、②細胞周期の制御に関与する細胞内プロセスの異常、などがあげられます。故に細胞周期エンジン構成分子群及び細胞周期制御に関与する細胞内プロセスは癌治療の有望なターゲットとなります。
細胞周期はcyclinsやcyclin-dependent
kinases(CDKs)などの細胞周期エンジンを構成する分子群により高度に調節されており(図1)、多くの癌細胞において、このような分子群が過剰に活性化されています。また特定の刺激により癌が発症する発癌動物モデルにおいて、これらの構成分子の働きを薬理学的および遺伝学的に阻害すると、癌の発症・進展が有意に抑制されることも明らかとなっています。興味深いことに、癌の種類によって、どの構成分子を阻害すると制癌効果があるのかが異なります。これらの知見は、異なる種類の癌細胞の増殖は特定の細胞周期エンジン構成分子にそれぞれ特異的に依存しており、それら構成分子の作用を選択的に阻害することにより、多種多様な癌の治療が可能になることを示唆します(Nat Rev Cancer.
2017;17(2):93-115)。
実臨床では、2015年に細胞周期エンジン構成分子を標的とした抗癌剤として世界で初めて、CDK4/6選択的阻害剤であるpalbociclib(IBRANCE®:
Pfizer)がER+/HER2-の閉経後進行乳癌を適応症として米国FDAによる条件付き承認を得ています。また現在、CDK4/6選択的阻害剤(乳癌、肺癌)、Polo-likeキナーゼ阻害剤(骨髄異形成症候群、膵癌)、Aurora阻害剤(T細胞リンパ腫)などの細胞周期エンジン構成分子を標的とした癌治療薬が臨床試験第3相まで進んでいます。
このように、細胞周期の制御は癌治療における有効なストラテジーの一つとして既に確立されており、細胞周期エンジンを構成する分子群を対象にした分子標的療法に関しては研究が進んでいます。一方、細胞周期に影響を及ぼす細胞内プロセスを標的とした治療法については研究が不十分であり、革新的な癌治療に繋がる余地が残されています。そのような背景をもとに細胞周期エンジンを構成する分子、タンパクの一つCDC6を標的とした治療が注目されます。
細胞に含まれるゲノムDNAは、細胞周期のS
期ごとに一回だけ複製されるように厳密にコントロールされています。
ゲノムの複製が正しく行われるためには、DNA複製開始点が十分に制御されていることが重要であり、複製開始のタイミングを制御するシステム(複製ライセンシングシステム)を構成する分子としてcell division
cycle 6 ATPase(CDC6)と称されるゲノム複製ライセンシングファクター(licensing
factors)が知られています。分裂をしている正常細胞において、このライセンシングファクターの活性は細胞周期依存的に調節されており、S期の前段階であるG1期においてのみ選択的に活性化され、S期及びG2期では完全にシャットオフされます。またゲノムの複製を必要としない正常細胞(休止期の細胞や終分化した細胞など)においては、ライセンシングファクター自体が蛋白分解されその活性は消失しています。
一方、前癌状態の細胞や癌細胞では、ライセンシングファクターであるCDC6の過剰発現により、ライセンシングファクターが制御する細胞内プロセスが破綻している事例が数多く報告されています。ライセンシングファクターの過剰発現によりゲノムの複製開始・進行プロセスに制御不全が生じると、DDR(DNA損傷反応)経路が活性化されますが、このような現象(replication
stress)は、正常細胞では認められず、前癌状態の細胞及び癌細胞に共通して認められるため、癌の発症進展のメカニズムとの関連が注目されています。動物モデルにおいてCDC6を過剰発現させると腫瘍が形成されることも知られており、また臨床的にはCDC6が高発現している膵癌は予後不良との報告もあります。これらの知見は、細胞に過剰に存在するライセンシングファクター分子が、replication
stressからゲノムの不安定性を引き起こし、癌遺伝子として働くことを示唆されます(Nat Rev Cancer.
2015;15(5):276-89, Nat Rev Cancer.
2008;8(10):799-806)。
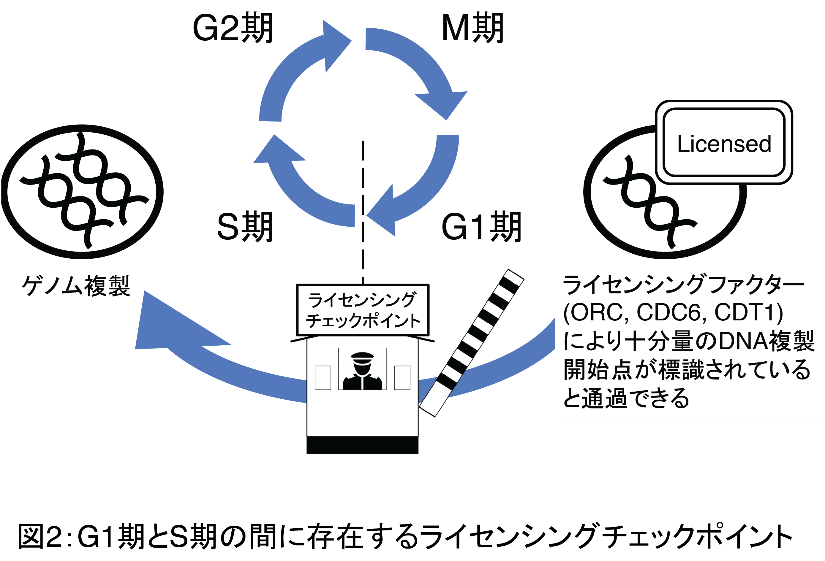
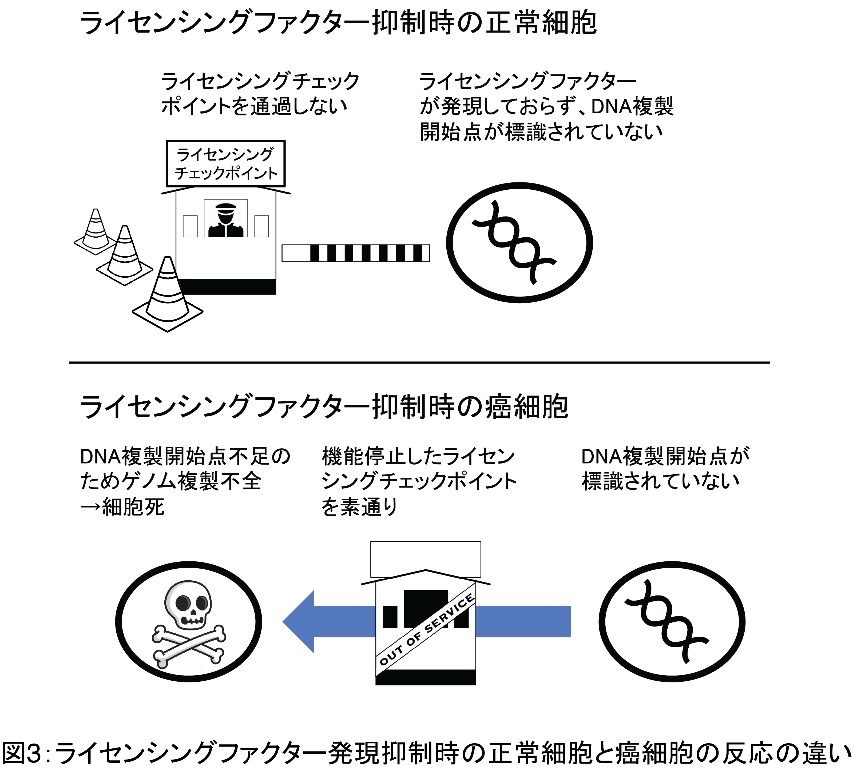
ライセンシングチェックポイントとは、ゲノムの完全性を保持するために正常細胞に備わっているフィードバック機構の一つです(図2)。ライセンシングチェックポイントは、ライセンスされたDNA複製開始点がG1期に十分量用意されていることを細胞が確認するシステムであり、DNA複製開始点が十分量存在しないと判断された場合には、細胞はS期に移行することなくG1期に留まります。このフィードバック機構が機能しないと、ライセンスされたDNA複製開始点が十分に用意されていないにもかかわらずS期に突入し、DNA複製開始点不足のためにゲノム複製が正しく完了せず細胞は死に至ります。癌細胞ではこのライセンシングチェックポイントが破綻していることが判明しておりますが、複製ライセンシングシステムが遮断されていない状況では、DNA複製開始点の不足は生じないため、ライセンシングチェックポイントが破綻している癌細胞でも細胞死に至ることはありません。 「RNAiもしくは化合物を用いたライセンシングファクターの発現量・活性を抑制する治療法」により細胞の複製ライセンシングシステムが遮断されると、ライセンスされたDNA複製開始点が十分量用意されない状況が全身の細胞に生じます。正常細胞はG1期に一旦留まり、薬剤による治療効果が減弱した時点で再びライセンスされたDNA複製開始点を補充しS期に移行するため、治療によるダメージは限定的です。一方、癌細胞は複製ライセンシングシステムの遮断によりライセンスされたDNA複製開始点が十分に用意されない状況でもS期に移行するため死に至ります(図3)。このようにライセンシングファクターであるCDC6をRNAiによりknock
downする治療には既存の治療法にはない潜在的な優位性があります。
以上の科学的背景に立脚したCDC6 RNAi
治療を、他に有効な治療法がない癌患者さんに対して、十分なインフォームドコンセプトのもとに提供しています。