国内初 がん免疫遺伝子治療が保険承認cancergenetherapy
遺伝子治療の種類
遺伝子治療にはいくつかの種類があり、
a.先天的に欠落した遺伝子を補充する治療
b.免疫細胞に体外で遺伝子操作及び培養増殖したものを投与する治療
c.病原性の根幹となるタンパクをターゲットにしたRNA干渉を軸にするもの
などが挙げられます。また、ZFN(ズィーエフエヌ、またはジンクフィンガーヌクレアーゼ)、TALEN(タレン)、CRISPR/Cas9(クリスパー・キャスナイン)などの部位特異的ヌクレアーゼを利用した
d. ゲノム編集と呼ばれる標的遺伝子を改変する技術
も登場しています。
がんは複数の遺伝子の突然変異が背景にあるため、aやdの技術はその治療において現実的ではありません。がん治療においては上記のbもしくはcの技術の応用が期待されます。
がん免疫遺伝子治療(CAR-T療法)が国内で初めて保険承認
2019年3月、上記bに当たる、がん免疫遺伝子治療(CAR-T療法)が、国内で初めて保険承認されました。この治療は、がん細胞への攻撃力を高めるために、患者さんから採取した免疫細胞(T細胞)を遺伝子導入により改変して患者さんの体内に戻すという新しいタイプのがん治療法です。
CARとは、がん細胞表面に発現する特定の抗原を認識して攻撃するように設計された特殊な蛋白質です。CARを作り出すことができるようになったT細胞をCAR‐T細胞と呼びます。それをがん患者さんに投与すると、CARが、がん細胞の抗原と結合してT細胞を活性化させ、がん細胞を強力に死滅させることが期待できます。患者さん自身の細胞(T細胞)を用いて治療することから従来の治療法とは大きく異なります。T細胞の培養には昨今注目されている自己幹細胞を用いた再生医療の手法と同様の技術を用います。(再生医療とは)
CAR-T療法の治療適応
CAR-T療法は、他に打つ手のない患者さんに治癒をもたらす可能性がありますが、誰でも受けられる治療法ではありません。また、重篤な副作用のリスクがあります。国際臨床試験での投与患者の1年生存率は50%であり夢の治療法と呼べるものではありません。しかし、既存治療に比べると高い有効性を持ち、再発または難治性の、CD19陽性びまん性大細胞型B細胞リンパ腫およびCD19陽性のB細胞性急性リンパ芽球性白血病など血液がんに対して適応となります。 これらの疾患は生命予後が極めて悪く、二次治療としての化学療法を開始後、1年生存率は約25%にとどまります。
CAR-T療法の治療効果、副作用
2019年6月の医学新聞メディカルトリビューンには、国際共同大Ⅱ相試験で難治性のCD19陽性びまん性大細胞型B細胞リンパ腫に対するCAR-T療法の奏効率は51.6%、日本人でも高い奏効割合(投与患者の66.7%が寛解、かつ深い寛解)であったと報告されています。
一方で、過剰な免疫反応による重篤な副作用が高頻度に現れるので、治療中は細心の注意が必要とも言われています。すなわち、高熱、血圧低下、呼吸困難、意識障害の他に、重症例では、サイトカイン放出症候群、脳症、神経毒性、血球減少など、集中治療室での治療が必要になる副作用が発生することがあります。
歴史を変える治療と期待されるが課題もある
難治性の血液系のがんに対して今までには考えられない画期的な治療効果が期待できることから、「CAR-T療法は、がん治療の歴史を変える」と述べる医師もおられます。しかし、肺がん、胃がん、大腸がんなどの一般的な固形がんに対しては、効果が得られていません。固形がんに対するCAR-T療法は、治療標的となるがん特異的蛋白質が腫瘍上で同定されていないことと、かつ送達経路であるがんの新生血管の中を製剤が通過しないため、成功に至っていないのです。さらに、固形がんは、T細胞の攻撃をかわす免疫抑制分子に守られているだけでなく、細胞外マトリックス(ECM)と呼ばれるクモの巣状の蛋白質によっても保護されています。 固形がんに対してCAR-T療法が応用されるようになるには、標的の同定と送達経路の確保が課題です。
また、極めて高額な薬価(1回の治療3,000万円超)も注目されています。現在は対象となる国内の患者数が250名程度ですが、今後多くのがんの患者さんが治療適応になっていく上では薬価の軽減が必要になるでしょう。
CDC6 RNAi 療法は固形がんに対して効果が期待
北青山Dクリニックで導入しているCDC6 RNAi 療法は固形がんに対しても治療効果が期待できます。この治療は、前述のdに相当するもので、治療ターゲットは、がん細胞の無限増殖に関連する細胞周期制御蛋白になります。非病原性のウイルスベクターを用いて固形がん細胞内にRNA干渉製剤を送達することができます。大きな副作用がないことも期待できる点です。課題は、大量のRNA干渉製剤を作成する製造技術の確立がまだ得られていないことです。
さらに、未承認治療薬のため、広く普及させていくためには、アカデミアなどの研究機関で科学的証拠の確立を行ったうえで適切かつ十分な規模の臨床試験が必要です。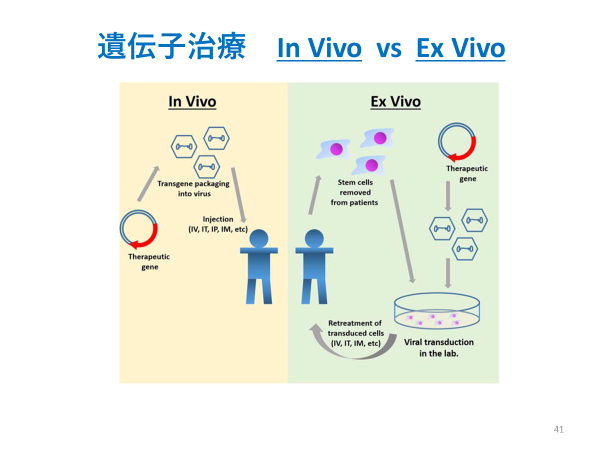
CAR-T療法は図の右側(Ex Vivoの遺伝子治療)
CDC6 RNAi療法は左側(In Vivoの遺伝子治療)